Il vaccino Pfizer è efficace al 95%. L'immunologa Viola ci illustra il suo funzionamento

Il vaccino sviluppato dall’azienda statunitense Pfizer insieme alla tedesca BioNTech è efficace al 95%, anche tra le persone che, per età o comorbidità, corrono maggiori rischi di ammalarsi di Covid-19 in forma severa.
I dati sulla sperimentazione di fase 3 sono stati pubblicati il 10 dicembre sull’autorevole rivista New England Journal of Medicine che in un editoriale ha definito i risultati un vero “trionfo”, pur ricordando l’importanza di un monitoraggio che continui per un lungo periodo.
Lo studio randomizzato e controllato ha coinvolto 43.548 persone di età superiore ai 16 anni. 21.720 hanno ricevuto il vaccino, (indicato con la sigliaBNT162b2) e 21.728 il placebo. I casi accertati di contagio da SARS-CoV-2 tra coloro che avevano ricevuto le due dosi di vaccino previste dal trattamento sono stati 8, a fronte di 162 nel gruppo a cui era stato somministrato il placebo. Tra i dieci partecipanti alla sperimentazione che si sono ammalati di Covid-19 in forma grave uno solo aveva ricevuto il trattamento.
Il vaccino, spiegano gli autori dell’articolo, ha dimostrato di avere un’efficacia simile (generalmente dal 90 al 100%) nei sottogruppi definiti per età, sesso, razza, etnia, indice di massa corporea e presenza di malattie preesistenti. Sotto il profilo della sicurezza gli effetti collaterali osservati sono stati lievi: dolore, da lieve a moderato, nel punto dell’iniezione, affaticamento, brividi, febbre e mal di testa. L'incidenza di eventi avversi gravi è stata bassa ed è risultata simile nei gruppi che hanno ricevuto il vaccino e in quelli a cui era stato dato il placebo. Un’accortezza particolare è però necessaria per chi ha “una significativa storia clinica” di allergie e l’autorità britannica di controllo sui farmaci (Mhra) ha consigliato a questa categoria di persone di non sottoporsi alla vaccinazione, almeno fino a quando non sarà chiarito cosa abbia causato le reazioni allergiche sviluppate da due operatori sanitari inglesi che avevano ricevuto il vaccino.
NEWS: @NEJM published safety and final efficacy results from the Phase 3 trial of our #COVID19 vaccine, developed w/ @BioNTech_Group, confirming the candidate was well tolerated & demonstrated a 95% efficacy in those who participated in the trial. https://t.co/Ixg4I6qkWp pic.twitter.com/3PyzX4OETK
— Pfizer Inc. (@pfizer) December 10, 2020
La pubblicazione dei dati era molto attesa perché occorreva dare robustezza agli annunci della aziende produttrici, permettendo alla comunità scientifica di esaminare le informazioni. E i risultati della sperimentazione infondono ottimismo anche in Italia, in vista dell’arrivo del primo vaccino che ha già ricevuto il via libera dalle autorità regolatorie di Regno Unito, Canada e Stati Uniti e sul quale dovrebbe esprimersi favorevolmente anche l’Ema, l’agenzia europea per i medicinali, la cui decisione, inizialmente prevista per il 29 dicembre, è stata anticipata di 8 giorni ed è adesso fissata per il 21 dicembre.
Poter disporre di un vaccino che in 95 casi su 100 impedisce al virus SARS-CoV-2 di provocare sintomi è certamente un punto di svolta, soprattutto davanti a una malattia caratterizzata da un decorso clinico a volte imprevedibile che può arrivare a porre sotto attacco diversi organi umani. E, ricorda l’editoriale del New England Journal of Medicine firmato dall’immunologo Eric Rubin e dall’onco-ematologo Dan Longo, il percorso dal concepimento all'implementazione su larga scala potrebbe completarsi nell’arco di meno di un anno.
Un’impresa mai riuscita prima d’ora.
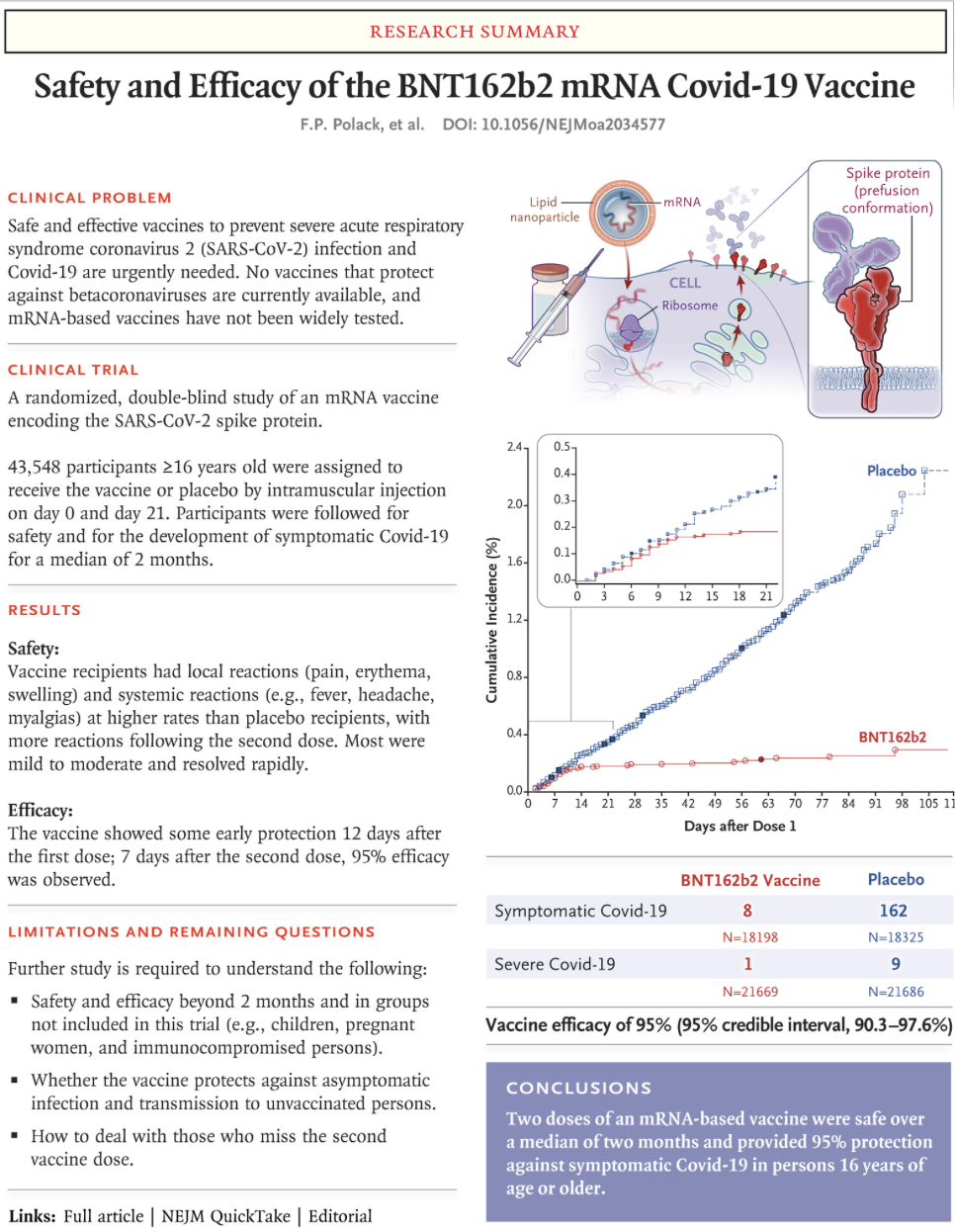
Scheda riassuntiva su sicurezza ed efficacia del vaccino Pfizer/BioNTech tratta dall'articolo del New England Journal of Medicine
Gli esperti ricordano comunque che restano ancora dei punti da chiarire: sarà necessario capire in che misura le persone vaccinate possono eventualmente infettarsi e restare asintomatiche e sarà fondamentale anche monitorare gli eventuali effetti collaterali su un periodo di tempo più lungo. Inoltre non bisogna dimenticare gli aspetti logistici collegati al fatto che il vaccino Pfizer/BioNTech deve essere conservato a una temperatura di -70°C. Un fattore, sottolinea l’editoriale del New England Journal of Medicine che “potrebbe limitarne la diffusione in alcune aree”. Tuttavia, precisano gli autori, “il notevole livello di sicurezza ed efficacia che il vaccino ha dimostrato fino ad ora, fanno di questo un problema che dovremmo accogliere con favore”.
E il vaccino che è arrivato per primo è anche quello sviluppato con la tecnologia più innovativa, quella a RNA messaggero (mRNA) che codifica la proteina chiave di SARS-CoV-2, l’ormai nota Spike, il grimaldello con cui il virus riesce ad aprire i recettori Ace 2, ampiamente presenti nelle vie respiratorie e nei tessuti, e ad entrare così nelle cellule per iniziare la replicazione. Si tratta dello stesso meccanismo che è alla base del vaccino sviluppato da Moderna e al quale la Food and Drug Administration statunitense dovrebbe dare il via libera proprio in queste ore. L’idea è quella di stimolare il nostro organismo a produrre una risposta immunitaria proprio attraverso la proteina Spike, che senza la parte restante del virus è innocua: in questo modo se in futuro la persona vaccinata dovesse incontrare SARS-CoV-2 avrebbe già in dotazione gli anticorpi necessari a riconoscere la Spike e a eliminare il patogeno.
“E’ il primo vaccino di questo genere ma la tecnologia su cui si basa è studiata da anni, soprattutto nell’ambito dell’immunoterapia per la cura dei tumori”, precisa l’immunologa Antonella Viola, professoressa del dipartimento di Scienze biomediche dell’università di Padova, a cui abbiamo chiesto di spiegarci come funziona esattamente il suo meccanismo di azione.
L'intervista completa all'immunologa Antonella Viola sul vaccino Pfizer/BIoNtech, il primo che arriverà in Italia. Servizio e montaggio di Barbara Paknazar
"La composizione di questo vaccino - introduce la professoressa Antonella Viola - è estremamente semplice: una nanoparticella costitutita da lipidi che funzionano come un contenitore al cui interno c’è l’Rna messaggero che serve a portare all’interno del citoplasma delle nostre cellule il messaggio che induce alla produzione della proteina Spike".
"L’RNA messaggero - precisa subito l'immunologa dell'università di Padova - non penetra nel nostro nucleo e non entra per niente a contatto con il nostro Dna. Non esiste quindi alcun rischio che lo vada a modificare. Attiverà la produzione della Spike e poi si degraderà perché è una molecola estremamente labile e non dura nel tempo. Le nostre cellule avvieranno una specie di micro laboratorio finalizzato alla produzione della proteina Spike e il sistema immunitario, che non ha mai visto questa proteina, la riconoscerà come qualcosa di estraneo e inizierà a produrre anticorpi. Nel caso di un futuro contatto con SARS-CoV-2 questi anticorpi saranno neutralizzanti perché saranno capaci di riconoscere la proteina Spike e quindi potranno bloccare l’ingresso del virus nelle nostre cellule dal momento che, come sappiamo, questa proteina è la chiave usata dal patogeno per entrare nell’organismo umano".
Grazie all'RNA messaggero il nostro organismo sarà quindi in grado di costruire un efficace meccanismo di difesa senza aver mai visto il virus. E per quanto riguarda gli effetti collaterali che possono far seguito alla somministrazione del vaccino "i più comuni sono il dolore e l’arrossamento nel sito dell’inoculo, dove viene fatta l’iniezione. Inoltre circa il 16% dei pazienti al di sotto dei 55 anni sviluppa febbre, ma questo rialzo della temperatura scompare nel giro di un paio di giorni. In generale gli effetti collaterali che possono fare seguito alla prima dose sono più leggeri perché il sistema immunitario non è ancora molto attivo. Quando eseguiamo il richiamo, che serve attivare bene il sistema immunitario, emergono più frequentemente quei sintomi che tipicamente sviluppiamo quando abbiamo un’infezione, come la febbre o il senso di stanchezza. Questi sintomi collegati alla ricezione del vaccino sono comunque tutti transienti", spiega la professoressa Viola.
Le reazioni allergiche sviluppate da due persone con l'avvio della campagna di vaccinazione in Inghilterra "non erano state mai rilevate durante la fase tre della sperimentazione", dal quale erano comunque state esclusi coloro che avevano manifestato reazioni severe nel loro passato, ma gli episodi avvenuti "riguardano soggetti con una precedente storia di anafilassi. Non stiamo quindi parlando di chi è allergico ai pollini in primavera o al pelo del gatto, ma di persone che hanno già avuto episodi molto severi di attacco allergico in tutto il corpo e che devono andare in giro con i farmaci salva vita, come l’adrenalina", sottolinea l'immunologa.
Non è ancora noto quale sia stata la componente che ha provocato la reazione allergica e quindi per sicurezza l’autorità britannica ha raccomandato di non vaccinare più le persone che hanno un episodio storico di anafilassi sistemica e che di solito sono allergiche ai farmaci. Anche negli Stati Uniti, dopo l'avvio della campagna di vaccinazione, è stata registrata una grave reazione allergica. E' accaduto in Alaska a un'operatrice sanitaria che, secondo quanto riportano i media statunitensi, non aveva mai avuto problemi simili in passato. La donna, che ha trascorso una notte in terapia intensiva e adesso è in buone condizioni, non riceverà la seconda dose del trattamento.
Oltre alle persone che hanno una storia di anafilassi per il momento non potranno vaccinarsi anche bambini e ragazzi di età inferiore ai 16 anni e le donne in gravidanza, in quanto sono categorie che non sono state incluse nello studio. "Per il resto stiamo aspettando le indicazioni da parte dell’Ema. Il punto è che questo è un vaccino nuovo e quindi non abbiamo esperienza. Ad esempio per i pazienti con malattie autoimmuni nella grande maggioranza dei casi la vaccinazione contro l’influenza e il pneumococco è consigliata. Io penso che potranno ricevere anche questo vaccino, ma dobbiamo vedere cosa decideranno Ema e l’Aifa. Serve una valutazione molto attenta anche per le persone che hanno subito un trapianto", continua la professoressa Viola.
Sulla persistenza della protezione non è invece ancora possibile avere delle risposte e un altro interrogativo ancora aperto riguarda la capacità del vaccino di proteggere anche dalla trasmissione del virus. Sulla questione il Wall Street Journal riporta che il vaccino di Moderna, basato sulla stessa tecnologia a RNA messaggero, sembra capace di bloccare anche le infezioni asintomatiche. L'affermazione si basa sulla pubblicazione online da parte della Fda di documenti, preparati dal suo staff e da Moderna, che analizzano la sicurezza e l'efficacia del vaccino in un ampio studio clinico.
LEGGI ANCHE:
Tornando al vaccino Pfizer/BioNtech l'immunologa Antonella Viola conferma che "gli studi di fase tre hanno potuto dirci che questo vaccino è efficace e sicuro ma ovviamente non potevano offrirci delle informazioni sulla durata dell’immunità. La sperimentazione non è conclusa: le persone che sono state vaccinate continuano ad essere seguite nel tempo, sia per vedere quanto dura la protezione, sia per capire se ci sono degli effetti collaterali a lungo termine".
"Un altro aspetto a cui ancora non possiamo dare una risposta è se il vaccino può proteggere anche dal contagio o solo dallo sviluppo dei sintomi della malattia. Sappiamo però che negli studi sugli animali, in particolare sui macachi, questo vaccino era in grado di bloccare anche il contagio. Speriamo quindi che accada lo stesso anche sugli uomini", conclude Viola.