Gene drive: una biotecnologia per estinguere la malaria

La malaria colpisce ogni anno quasi 220 milioni di persone e ne uccide circa 435.000, più del 90% delle quali in Africa. Secondo i dati rilasciati a novembre 2018 dall'Organizzazione mondiale della sanità (Oms), nel 2000 le morti erano quasi un milione, mentre sono drasticamente calate, del 50%, nel 2017. Il successo è dovuto a una serie di misure: alcune più sofisticate, come nuovi insetticidi, bonifiche, nuovi farmaci e vaccini; altre molto più semplici ma sorprendentemente efficaci, come le zanzariere da letto.
Di oltre 3.000 specie di zanzare al mondo, 460 appartengono al genere Anopheles (in greco significa “senza scopo”, “inutile”). Di queste solo alcune decine ospitano, nel loro stomaco, il parassita della malaria, il Plasmodium, mentre meno di 10 specie sono vettori di Plasmodium falciparum, la forma più letale.
I costi della malaria non sono solo umani. Le stime sono arrivate a fissare all'1,3% la quantità di Pil perso ogni anno dai Paesi più colpiti dal morbo (principalmente africani e India), tra spese sanitarie, mancata produttività e mancato accesso all'istruzione.
Negli ultimi anni la guerra contro la malaria ha però segnato una battuta d'arresto: i dati delle infezioni e delle morti nel 2017 non differiscono in modo sostanziale da quelli del 2015. Una delle ragioni potrebbe essere che la zanzara sta sviluppando una forma di resistenza agli insetticidi. In evoluzione si chiama corsa agli armamenti (arms race): tra due specie in competizione, ad ogni azione corrisponderà, al passare delle generazioni, una reazione evolutiva da parte dell'organismo rivale, che farà di tutto per vincere la lotta per la sopravvivenza. Le carte delle zanzariere e degli insetticidi ce la siamo già giocate. Occorre qualcosa di più elaborato e la nostra prossima mossa potrebbe essere un vero asso nella manica.
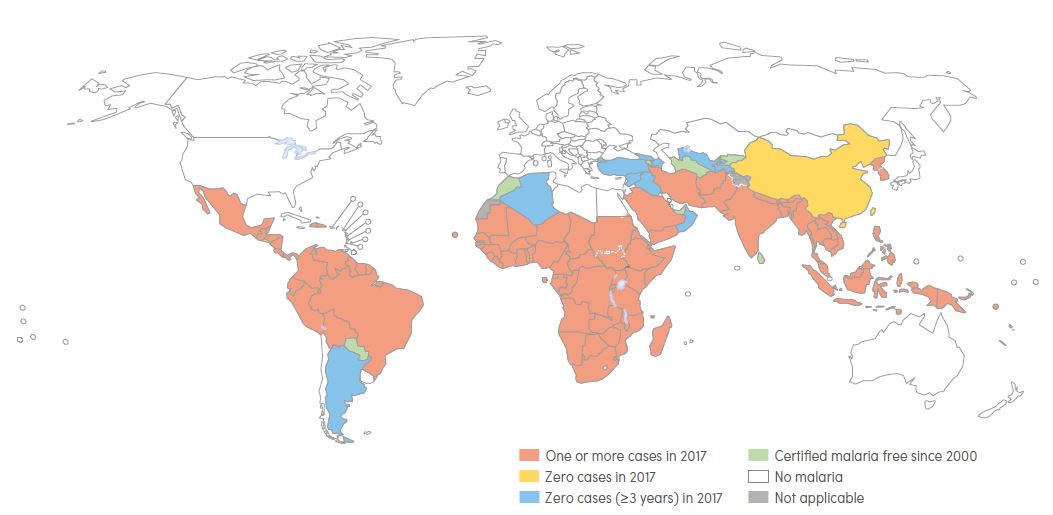
Mappa della malaria nel mondo. In rosso: uno o più casi nel 2017; in giallo: nessun caso nel 2017; in azzurro: nessun caso nei 3 anni precedenti al 2017; in verde: presenza di malaria dal 2000. Report Malaria 2018, Oms
Si chiama gene drive, in italiano suonerebbe come “spinta genetica” o “controllo genetico”. È una biotecnologia che sta venendo messa a punto, tra gli altri laboratori, da Andrea Crisanti, all'Imperial College di Londra. L'idea nasce nel 2000 quando per la prima volta Flaminia Catteruccia, ricercatrice italiana dell'Imperial College (oggi trasferitasi a Harvard), riesce a modificare stabilmente il genoma di una zanzara (Anopheles stephensi). Due anni più tardi si ottiene il genoma completo dell'insetto e nel 2003 gli studi di un professore canadese dell'Imperial College, Austin Burt, spalancano le porte alla realizzazione di idee che per 40 anni erano state solo fantascienza: controllare le popolazioni di insetti vettori attraverso la modificazione del loro genoma.
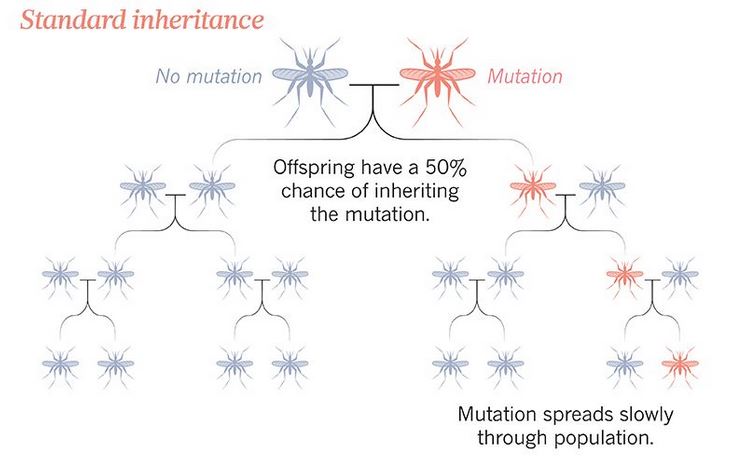
Solitamente un gene aumenta la sua frequenza all'interno di una popolazione, nel corso delle generazioni, se costituisce un vantaggio per l'organismo in cui è espresso: è così che funziona la selezione naturale. Esistono tuttavia alcuni geni capaci di diffondersi senza che siano portatori di alcun vantaggio, ma solo in quanto molto bravi ad auto-trascriversi.
Burt aveva individuato una particolare classe di “geni egoisti” (Home endonuclease genes - Heg), capaci di autoreplicarsi con grande efficienza grazie a un'operazione di taglia (di cui è responsabile l'enzima endonucleasi) e copia (che sfrutta i meccanismi di riparazione del Dna) con cui trascrivono la propria sequenza da un cromosoma a un altro, aumentando così la probabilità di venire trasmessi alle generazioni successive.
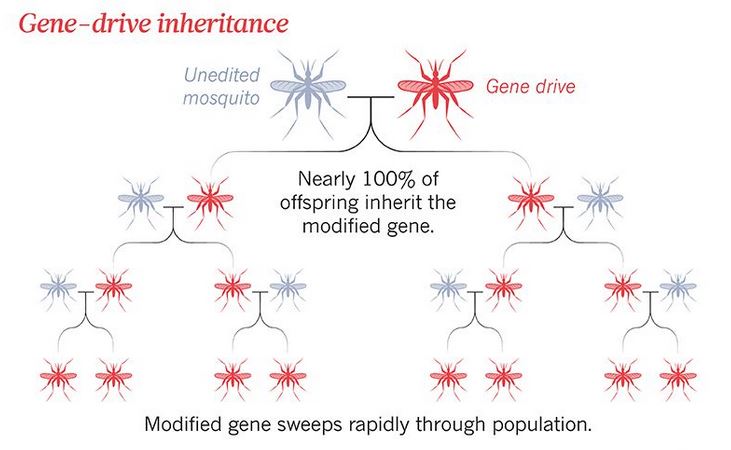
Il gene drive all'inizio è stato pensato proprio con questo meccanismo, allo scopo di aumentare (o diminuire) la frequenza di un dato tratto all'interno di una popolazione: intervenendo sul genoma, l'uomo forza una specie a diffondere o a estinguere una certa caratteristica.
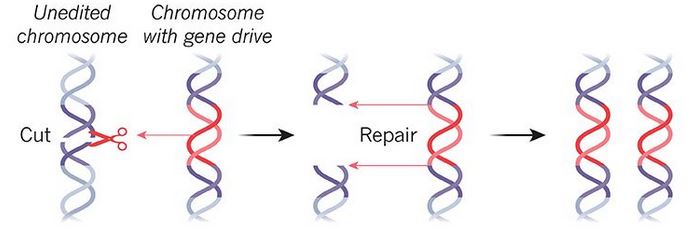
Meccanismo di funzionamento del gene drive: Crispr viene utilizzato per inserire una specifica sequenza genetica e diffonderla a tassi di ereditarietà più elevati del normale. Nature: Megan Scudellari 09/07/2019
Negli anni sono state sviluppate diverse tecniche genetiche di questo tipo: oltre a Heg, Zfn (Zinc finger nuclease) e Talen (Transcription activator-like effector nuclease). Ma è stata quella sviluppata nel 2012 a rubare la scena a tutte le altre per gli elevatissimi livelli di precisione raggiunti e la facilità di utilizzo: CrisprCas9 oggi è la biotecnologia più utilizzata al mondo per modificare una qualsiasi porzione di genoma di qualsiasi organismo. Nel 2015 Kevin Esvelt, nel laboratorio di Harvard di George Church, con Crispr ha ingegnerizzato il primo gene drive funzionante su zanzare.
Per bloccare la diffusione o la riproduzione delle zanzare occorre dunque individuare un gene chiave e equipaggiarlo con il drive, ovvero un dispositivo molecolare che ne assicuri l'ereditabilità alla discendenza. I ricercatori londinesi hanno identificato un gene bersaglio molto preciso nel genoma della zanzara: si chiama doublesex ed è una sorta di interruttore genetico per la determinazione del sesso dell'insetto (maschio o femmina).
Crisanti e i suoi colleghi sono riusciti a ingegnerizzare un gene drive che colpisce esclusivamente le zanzare femmine (Anopheles gambiae), quelle responsabili delle punture appunto e della trasmissione della malaria (i maschi sono invece impollinatori). Modificando doublesex hanno ottenuto una zanzara femmina, con caratteristiche morfologiche intermedie tra i due sessi, sterile e incapace di pungere. Sono anche riusciti a dimostrare, nel 2018 su Nature Biotechnology, che l'introduzione di questa zanzara geneticamente modificata all'interno di una popolazione di laboratorio, portera quest'ultima a estinzione nel giro di qualche generazione, poiché ne arresta la capacità riproduttiva.
Come spiegato da Crisanti e colleghi in un saggio pubblicato sull'almanacco della scienza di MicroMega, la tipologia di gene drive appena descritta è detta di soppressione della popolazione ed è considerata al momento la strada più sicura da percorrere. Un'alternativa sarebbe la sostituzione della popolazione: si introdurrebbero zanzare immuni alla malaria che sostituirebbero gradualmente quelle portatrici di Plasmodium. Le ricerche in questo ambito non sono tuttavia progredite come nel primo.
Un'altra strategia di soppressione oggi in fase di sviluppo è volta all'aumento di zanzare maschio, che non pungono, non trasmettono la malaria e non depositano le uova. Innestando il gene drive sul cromosoma Y (quello che determina il sesso maschile), in poche generazioni aumenterebbero esponenzialmente gli individui maschi, scomparirebbero gradualmente le femmine e la popolazione andrebbe al collasso.
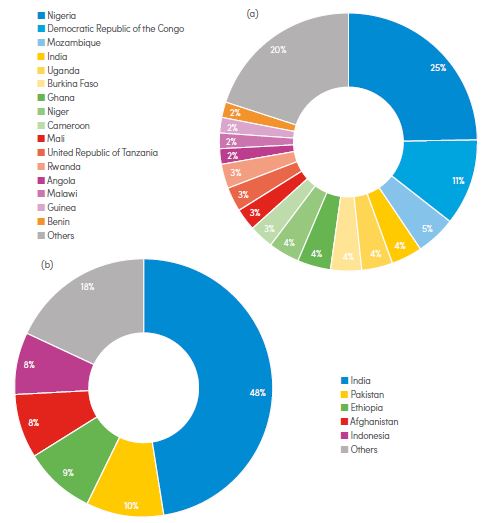
Distribuzione in percentuali nei Paesi del mondo di (a) malaria e di (b) malaria vivax, variante di malaria trasmessa da Plasmodium vivax (meno letale di Plasmodium falciparum). Report Malaria 2018, Oms
Il gene drive è una biotecnologia che deve ancora dimostrare la sua completa efficacia, ma lo sviluppo delle ricerche è già in una fase avanzata. Oltre che per sconfiggere la malaria, potrà essere impiegato per eradicare altre malattie veicolate da insetti vettori, come la dengue, la zika, la chikungunya e la febbre gialla. Ha inoltre delle enormi potenzialità ecologiche per la gestione delle popolazioni selvatiche, tema cruciale in un'era, l'Antropocene, in cui la biodiversità è crollata drasticamente. Oltre che sulle zanzare, oggi il gene drive si sta testando sui funghi, dove sembra efficace come per le zanzare, e addirittura su mammiferi con un genoma molto più simile al nostro, i topi, dove però non sembra ancora funzionare correttamente.
Le potenzialità di questa biotecnologia tuttavia vanno ben oltre le politiche di gestione della fauna selvatica, tanto che la Darpa, la sezione dedicata alla ricerca del Dipartimento della Difesa statunitense, ha già finanziato i progetti sul gene drive con 65 milioni di dollari, distribuiti tra 7 centri di ricerca negli Stati Uniti.
I quesiti che permangono sull'affidabilità del gene drive sono molti e un articolo su Nature ne ha recentemente sollevati alcuni, sia di carattere scientifico sia etico.
Una volta inserite in natura le zanzare geneticamente modificate, chi ci dice che mutazioni casuali non altereranno la sequenza genica dove è inserito il gene drive, rendendolo così inefficace? In altri termini, come possiamo essere sicuri che questo sistema davvero funzioni e non si perda per strada?
L'intervento su doublesex, cioè sul blocco della fertilità delle zanzare femmina, al momento è considerato l'approccio più promettente, perché sembra aver risolto questo problema. Bersaglia un gene molto conservato, che ha una funzione molto importante (la determinazione del sesso), il che significa che difficilmente potrà essere soggetto a mutazioni casuali deleterie che ne alterino la frequenza nella popolazione.
Occorre chiedersi poi se una volta innescata la reazione a catena del gene drive questa non possa andare completamente fuori controllo. A questa eventualità hanno già pensato sia i ricercatori di Harvard che per primi hanno ingegnerizzato il genoma della zanzara, sia il gruppo di Andrea Crisanti a Londra: per ogni gene drive viene preparato anche il meccanismo contrario che serve ad arrestarne la diffusione.
Il 1 luglio, all'interno del progetto Target Malaria, è stato rilasciato in un villaggio del Burkina Faso (Paese che ospita il 4% dei casi di malaria nel mondo) un primo gruppo di 6400 zanzare maschio, geneticamente modificate e sterili, ma non ancora equipaggiate con il gene drive, cioè con il meccanismo che accelera la diffusione del tratto 'sterilità'. La decisione è stata presa ad agosto dell'anno scorso dalla National Biosafety Agency del Burkina Faso. Secondo Crisanti, nel giro di tre anni la biotecnologia potrebbe essere pronta per il primo test in natura.
Come raccomandato nel documento prodotto l'anno scorso da un gruppo di 15 esperti per conto della Fondazione dell'NIH (National Institutes of Health), la decisione ultima sull'utilizzo del gene drive deve spettare ai governi, alle comunità e agli scienziati locali, dagli ecologi agli eticisti. E affinché il potere decisionale sia effettivamente distribuito è necessario che vengano assorbite le conoscenze necessarie a trattare queste tematiche. È necessario stimolare il dibattito sin da subito e lavorare per la diffusione delle informazioni disponibili. In un mondo che avanza a ritmi elevati occorre rispondere al cambiamento restando aperti alle novità, anche quando sembrano destabilizzanti.