In Salute. Trapianto di cuore: ieri, oggi, domani
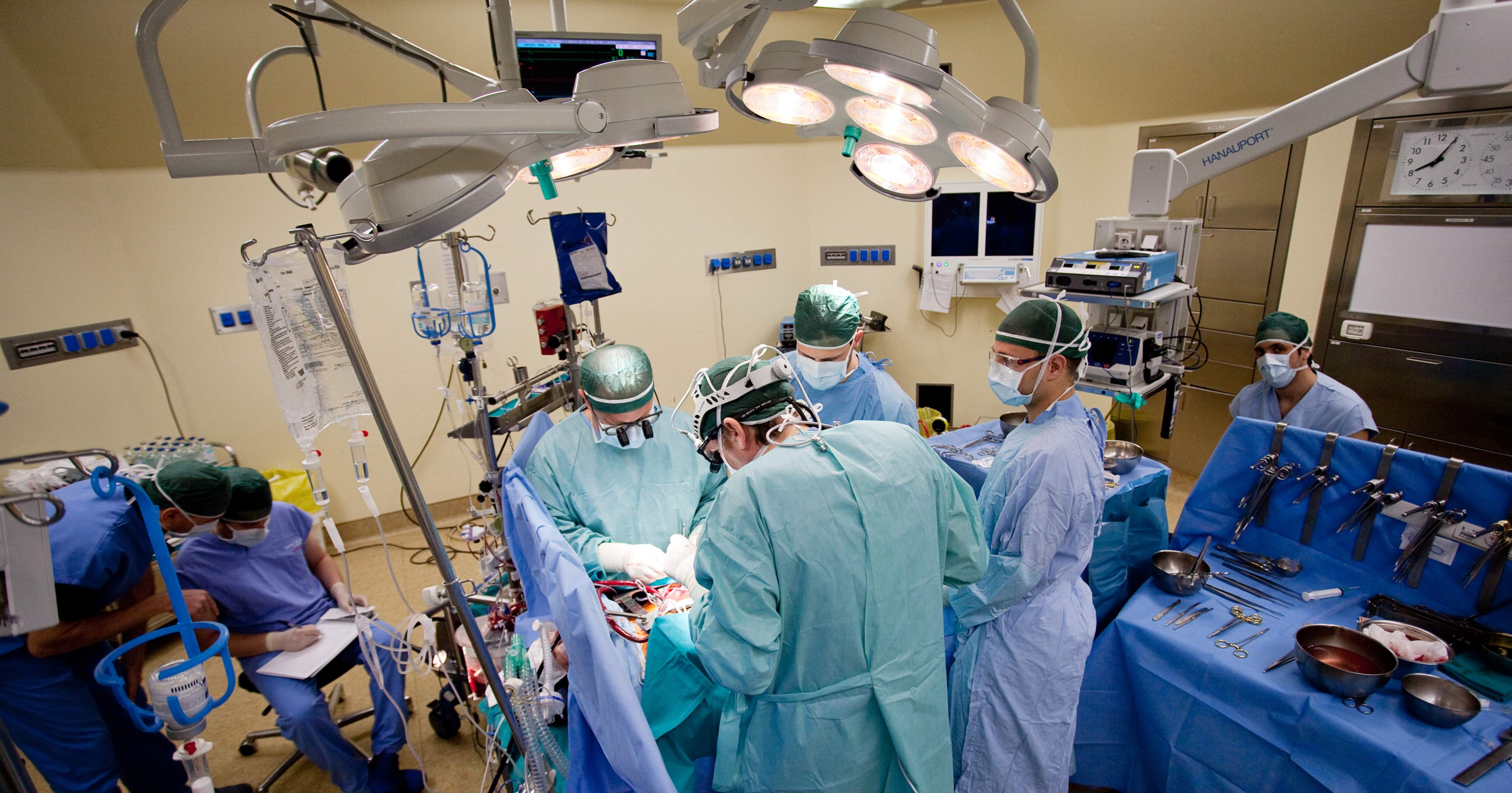
Gino Gerosa e la sua équipe durante un trapianto di cuore. Foto: Massimo Pistore
“Quando entriamo in sala operatoria, pensiamo innanzitutto al tipo di intervento che dobbiamo eseguire e, naturalmente, nel nostro retropensiero è sempre ben presente la responsabilità etica del paziente che ci affida la sua vita. Poi però dobbiamo concentrarci sul gesto tecnico. Al termine, quando il cuore torna a svolgere efficacemente la sua funzione di pompa, subentra una grande soddisfazione nel constatare che, proprio come accade a qualsiasi artigiano, il manufatto che abbiamo creato o riparato funziona correttamente, a conferma del fatto che il lavoro è stato eseguito in modo adeguato”. A distanza di quasi 60 anni dal primo trapianto di cuore al mondo eseguito da Christiaan Barnard in Sudafrica e a 40 dal primo in Italia, a Padova, ad opera di Vincenzo Gallucci, Gino Gerosa usa un’immagine efficace per descrivere lo spirito che, ora come un tempo, guida la mano di chirurghi e chirurghe. Da allora la ricerca scientifica e quella clinica, sostenute da intuizioni talora visionarie e dal progresso in ambito tecnologico, hanno permesso di compiere numerosi passi avanti, aprendo la strada a soluzioni sempre più efficaci e innovative nel campo dei trapianti e della cardiochirurgia.
Batte di nuovo dopo 20 minuti: aumentano i cuori disponibili
Molte persone oggi sono in lista d’attesa per un trapianto di cuore. Uomini e donne affetti da cardiopatie terminali, che non rispondono più alla terapia medica o all’intervento cardiochirurgico tradizionale. “Sebbene l’Italia sia ai primi posti in Europa come numero di donatori per milione di abitanti – osserva Gerosa, direttore del centro Gallucci dell’azienda ospedale-università di Padova e professore di chirurgia cardiaca nell’ateneo padovano –, nel tempo abbiamo assistito a una riduzione importante dei cuori che si possono trapiantare, perché si è modificato il profilo clinico del donatore: grazie alla legge sul casco la morte cerebrale post-traumatica è stata praticamente azzerata”. A questo punto però serve fare un passo indietro, per spiegare che l’accertamento di morte può avvenire secondo criteri neurologici, nel qual caso si parla per l’appunto di morte cerebrale, oppure secondo criteri cardiologici. Nella prima circostanza il cervello è irreversibilmente danneggiato, ma il cuore può continuare a battere se assistito da macchinari; nel secondo caso invece il cuore è fermo.
“Oggi – continua il cardiochirurgo – il donatore d’organi a cuore battente arriva alla morte cerebrale non in seguito a traumi, ma per eventi ischemici o emorragici cerebrali. Chiaramente in questi casi il paziente può presentare fattori di rischio come il diabete o l’ipertensione che, se non impattano negativamente su fegato, polmoni, e reni, possono comunque avere conseguenze negative sul cuore”.
Se dunque i donatori in morte cerebrale sono stati per molto la risorsa principale per i trapianti di cuore, nel tempo i medici hanno iniziato a considerare anche donatori in morte cardiaca, cioè a cuore fermo. Questo però in Italia poneva un ostacolo, e cioè la registrazione continua, per almeno 20 minuti secondo le normative vigenti, di un elettrocardiogramma piatto. Un intervallo di tempo molto più lungo di quello richiesto in altri Paesi. Il primo trapianto da donatore a cuore fermo in Europa fu eseguito nel 2015 in Inghilterra al Papworth Hospital nel Cambridgeshire: l’organo aveva cessato di battere da cinque minuti. Venti sembravano davvero troppi: se non fosse cambiata la legge, si riteneva non fosse possibile effettuare lo stesso tipo di intervento nel nostro Paese. Le cose, invece, andarono diversamente.
“Nel maggio 2023 a Padova – racconta il cardiochirurgo – abbiamo eseguito il primo trapianto di cuore in Italia da donatore a cuore fermo, e al mondo da donatore a cuore fermo con un tempo di ischemia funzionale calda di circa 45 minuti: il termine indica l’intervallo che intercorre tra il momento in cui il cuore comincia ad andare in sofferenza prima di fermarsi e i successivi 20 minuti per la certificazione della morte con la registrazione dell'elettrocardiogramma piatto”.
Da allora fino ad oggi in Italia sono stati eseguiti più di 60 trapianti di questo tipo, con una ripresa del cuore sempre buona. “Abbiamo aperto una strada che non si riteneva fosse percorribile e questa è una grande soddisfazione. Ma soprattutto è stato aumentato di circa il 30% il numero di cuori che abbiamo a disposizione per dare una risposta terapeutica efficace ed effettiva ai pazienti in lista d’attesa”.
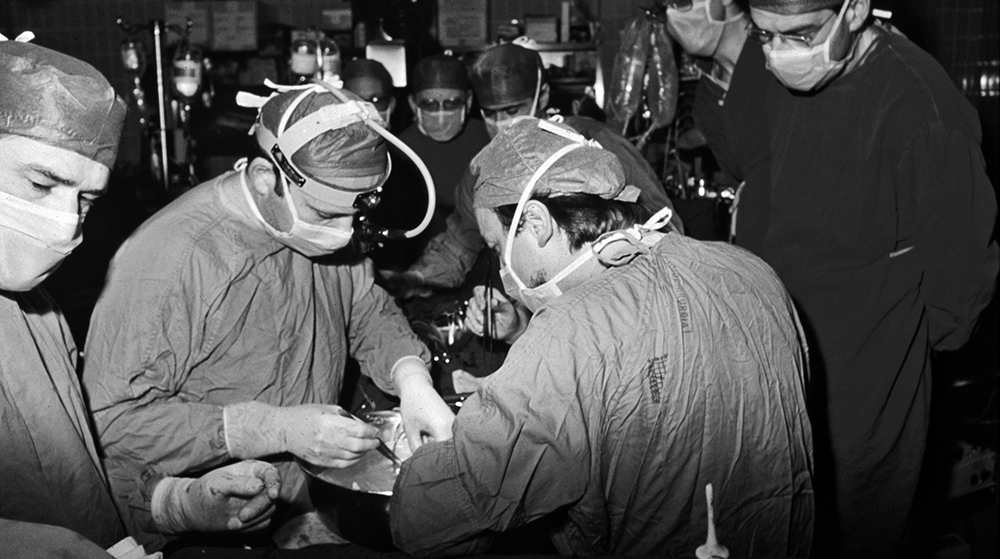
Vincenzo Gallucci esegue il primo trapianto di cuore in Italia, a Padova nel 1985
Dal donatore al ricevente: quando il cuore non smette mai di battere
Effettuare un trapianto da donatore a cuore fermo significa innanzitutto riattivare il cuore quando ancora è all’interno del corpo deceduto, per verificarne la funzionalità. Se l’organo risulta idoneo, viene nuovamente fermato, prelevato e trasferito nel centro dove sarà impiantato. Stop and go, stop and go.
A seconda della situazione, i medici hanno due possibilità per il trasporto: in un caso il cuore può rimanere fermo, in uno stato di arresto controllato, e fatto ripartire dopo l’impianto nel ricevente. In alternativa può essere riattivato e mantenuto a una temperatura di 37 gradi all’interno della macchina per la perfusione ex vivo, che permette di dilatare i tempi di trasporto del cuore. Quando viene trasportato in ipotermia, cioè a bassa temperatura, il tempo massimo disponibile tra il prelievo e l’impianto è di quattro ore; le macchine per la perfusione ex vivo invece consentono di dilatare i tempi fino a otto, dieci ore. Prima dell’impianto nel ricevente l’organo, però, deve essere nuovamente fermato. In entrambi i casi, il ripetuto arresto e riavvio del battito cardiaco determinano danni da ischemia e riperfusione al cuore.
“Perché non possiamo impiantarlo mentre sta ancora battendo?”. A porsi questa domanda è Joseph Woo cardiochirurgo della Stanford University che nell’ottobre del 2022 con la sua équipe esegue per la prima volta un trapianto a cuore battente, da donatore a cuore fermo: l’organo cioè non viene mai fermato prima dell’impianto, una volta tolto dalla macchina per la perfusione ex vivo rimane in attività.
Il passo successivo viene compiuto a Padova: se Woo aveva guardato alla fase finale, cioè all’impianto, Gerosa e la sua équipe si concentrano sul momento del prelievo dell’organo e nel dicembre 2024 eseguono il primo trapianto al mondo a cuore totalmente battente, da donatore a cuore fermo: “Una volta che il cuore è ripartito all'interno del donatore, l'abbiamo prelevato senza fermarlo, quindi continuando a perfondere le coronarie con il sangue del donatore. L'abbiamo inserito all'interno della macchina per la perfusione ex vivo, dove ha continuato a battere a 37 gradi. L'abbiamo trasferito a Padova, tolto dalla macchina senza fermarlo ed eseguito il trapianto. In questo modo abbiamo azzerato completamente quei momenti di stop and go che sono responsabili del danno da ischemia e riperfusione”. Oltre a ridurre complicazioni di questo tipo, inoltre, si contribuisce anche a prolungare la funzionalità dell’organo dopo il trapianto.

Foto: Massimo Pistore
Cuore artificiale totale: da soluzione temporanea a impianto definitivo
Purtroppo il numero di cuori disponibili oggi non è sufficiente a soddisfare le esigenze dei pazienti in lista d’attesa per un trapianto, e ciò ha reso necessario lo sviluppo di soluzioni alternative. “Una di queste è rappresentata dai sistemi di assistenza meccanica al circolo, che si dividono in Vad-Ventricular Assist Device, cioè sistemi di assistenza ventricolare, e cuore artificiale totale”. Il Vad aiuta la funzione contrattile del ventricolo sinistro, ma ciò presuppone che il ventricolo destro del paziente sia ben funzionante. Non sempre però è così, dato che a volte la persona può presentare una disfuzione biventricolare: in questi casi è necessario ricorrere a un cuore artificiale totale che va a sostituire quello del paziente.
“I cuori artificiali attualmente disponibili sono due, uno americano sviluppato alla fine della seconda guerra mondiale, il CardioWest, impiantato per la prima volta in Italia, a Padova, nel 2007. Estremamente rumoroso, in quanto pnmeumatico, è inteso come ponte al trapianto, perché non garantisce un’adeguata qualità di vita. Un secondo cuore artificiale è stato sviluppato in Francia e si chiama Carmat-Aeson: è silenzioso in quanto elettrico e non pneumatico e ha una miglior biocompatibilità, perché le quattro valvole meccaniche all'interno del CardioWest sono state sostituite da quattro valvole biologiche”.
Questo secondo modello è stato recentemente impiantato dall’équipe di cardiochirurgia dell’Azienda ospedaliera universitaria di Verona, dopo essere stato utilizzato anche a Napoli, Roma e Milano. “Sfortunatamente – continua Gerosa – è ancora troppo grande, quindi meno del 75% degli uomini e meno del 15% delle donne risultano idonei come potenziali riceventi”. E anche in questo caso può essere utilizzato solo come soluzione temporanea per il paziente in lista di attesa.
“È dunque importante riuscire a sviluppare un cuore artificiale che sia piccolo, quindi utilizzabile in tutti i soggetti, indipendentemente dal genere e dalle dimensioni corporee, silenzioso, estremamente biocompatibile per garantire la miglior qualità di vita, e che possa dunque essere utilizzato non più come ponte al trapianto in attesa di un organo umano, ma come soluzione definitiva”. Lo sviluppo di un cuore artificiale con queste caratteristiche è oggi un obiettivo di molti gruppi scientifici a livello internazionale, dal Nord America alla Germania, dal Giappone al Nord Corea, e anche Padova si sta muovendo in questa direzione. “L’auspicio è che si riesca a creare un cuore artificiale totale che possa garantire non solo la sopravvivenza del paziente ma anche un’eccellente qualità di vita”.
Foto: Massimo Pistore
Le nuove frontiere: dallo xenotrapianto all’ingegneria tissutale
Accanto al cuore artificiale, altre possibilità sono rappresentate dallo xenotrapianto, cioè l’impiego di cuore di maiale geneticamente modificato. Fino ad oggi sono stati eseguiti due trapianti di questo tipo: il primo nel gennaio del 2022 dai chirurghi della University of Maryland Medicine di Baltimora negli Stati Uniti, il secondo nel settembre del 2023 sempre dall’équipe del Maryland. I due pazienti sono vissuti alcune settimane. “Si tratta di maiali in cui sono stati silenziati alcuni geni tipici dell’animale e inseriti geni umani per migliorare la biocompatibilità. Molto però si deve ancora fare, soprattutto per quanto riguarda la terapia immunosoppressiva”.
Un'ipotesi alternativa consiste nell’utilizzare tecniche di ingegneria tissutale: la componente cellulare viene rimossa dal cuore del maiale (decellularizzazione) e sostituita con cellule del potenziale ricevente (ricellularizzazione). “A Padova, nel laboratorio di medicina rigenerativa della Cardiochirurgia, abbiamo messo a punto la tecnica di decellularizzazione: in un cuore di maiale riusciamo a rimuovere tutti i cardiomiociti, le cellule muscolari lisce e le cellule endoteliali, lasciando solamente uno scheletro di collagene ed elastina per poi ripopolarlo con le induced pluripotent stem cells (cellule staminali pluripotenti indotte) del potenziale ricevente. Se riuscissimo anche a mettere a punto una tecnologia per il popolamento, avremmo raggiunto l’obiettivo, perché avremmo un cuore naturalmente dotato del patrimonio genetico del paziente nel quale viene impiantato, che quindi non avrebbe necessità di terapia immunosoppressiva”.
Innovazione tecnologica e chirurgia microinvasiva
Cuore artificiale, xenotrapianto, ingegneria tissutale sono tutte strade oggi percorribili grazie anche ai progressi tecnologici degli ultimi decenni. “L'innovazione tecnologica in chirurgia ha un ruolo molto importante – osserva Gerosa –, perché consente di sviluppare nuove procedure chirurgiche. Naturalmente abbiamo bisogno anche di esperienza, perché solo accumulando esperienza, possiamo pensare a nuove soluzioni. Servono creatività, fantasia e coraggio chirurgico”. E conclude: “In questo percorso, la ricerca deve mettere il paziente al centro del processo scientifico e deve essere guidata da etica e coscienza, intesa come conoscenza”.
Uno degli ambiti in cui l’innovazione tecnologica trova oggi la sua massima espressione è la cardiochirurgia microinvasiva. “Oggi il nostro obiettivo è quello di garantire una buona qualità di vita ai nostri pazienti attraverso interventi sempre meno invasivi – argomenta Vincenzo Tarzia, cardiochirurgo dell’azienda ospedale-università di Padova e professore di chirurgia cardiaca microinvasiva nell’ateneo padovano –, trattando le alterazioni strutturali del cuore senza aprire la cavità cardiaca, senza fermare il cuore, e senza l'utilizzo della circolazione extracorporea”.
Normalmente l'intervento chirurgico standard viene effettuato aprendo lo sterno, collegando il paziente alla macchina cuore-polmoni e arrestando il cuore. Ora invece è possibile intervenire praticando solo delle piccole incisioni nella parete toracica, tra le coste, dove si trova una porta naturale per poter effettuare operazioni di questo tipo. In certi casi non è necessaria alcuna incisione chirurgica. “Ciò è possibile grazie all’utilizzo di cateteri e device. Osserviamo il cuore attraverso occhi esterni che possono essere di volta in volta delle telecamere, le immagini dell’ecocardiogramma transesofageo, o i raggi X in laparoscopia”.
Il concetto e la tecnica della cardiologia microinvasiva sono state sviluppate a Padova e questo ha permesso a chirurghi e chirurghe di intervenire su pazienti fino a quel momento inoperabili: “Siamo riusciti per esempio ad aspirare dei tumori all'interno del cuore – spiega Tarzia –, abbiamo potuto correggere vizi valvolari con riparazione della valvola mitralica, abbiamo eseguito sostituzioni valvolari sempre senza incisioni o con piccole incisioni senza fermare il cuore, e senza l'utilizzo della circolazione extra-corporea”.
Crediti video
Cuore artificiale CardioWest: Di JNakashima - Opera propria, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=5650306
Cuore artificiale Carmat-Aeson: foto Reuters
Christiaan Barnard: foto Max Scheler Estate/ Agentur Focus