L’Italia scommette su Oxford. Ma la corsa per il vaccino ha molti partecipanti (senza ancora garanzie)
I ministri della salute di Italia, Francia, Germania e Olanda hanno firmato un accordo con la multinazionale farmaceutica AstraZeneca per la distribuzione di 400 milioni di dosi del vaccino contro il Sars-CoV-2 al cui sviluppo sta lavorando il Jenner Institute dell’università di Oxford.
Secondo il documento dell’Organizzazione mondiale di sanità aggiornato al 9 giugno sono una decina i vaccini che hanno superato la fase preclinica di analisi in vitro e che si sono rivelati promettenti a sufficienza per essere ammessi alla fase clinica di sperimentazione sull’uomo. Tra questi, il vaccino della partrnership tra università di Oxford e AstraZeneca è quello attualmente ritenuto in fase più avanzata di sperimentazione.
“È il candidato vaccino più avanzato e più promettente” ha dichiarato il ministro della salute Roberto Speranza, che ha sottolineato anche il coinvolgimento italiano nella sua realizzazione. L’azienda Irbm di Pomezia, che opera nel settore delle biotecnologie ed è presieduta da Piero Di Lorenzo, è coinvolta nella produzione tramite la società partecipata Advent. Mentre sarà la Catalent di Anagni a occuparsi dell’infialamento quando sarà pronto. Le stime più ottimistiche vedrebbero l’inizio della produzione già a fine agosto, per distribuirlo alla popolazione italiana ed europea in autunno o prima della fine dell’anno.
Lorenzo Wittum, presidente di AstraZeneca Italia, ha dichiarato che i meccanismi di distribuzione del vaccino in Europa dovranno venire decisi dai 4 Paesi firmatari dell’accordo insieme all’Unione Europea. “Per me andrà sempre considerato un bene pubblico globale, diritto di tutti, non privilegio di pochi” ha dichiarato in un post su Facebook il ministro Speranza. I costi di distribuzione, almeno in Italia, dovrebbero essere sostenuti dallo Stato, anche se non c'è ancora un piano dettagliato su come si svolgerà la futura campagna di vaccinazione.
Intanto anche l'Unione Europea ha firmato un accordo di acquisto anticipato con alcuni produttori di vaccini per garantire le necessità di tutti i Paesi membri: circa 2,5 i miliardi di euro messi in campo.
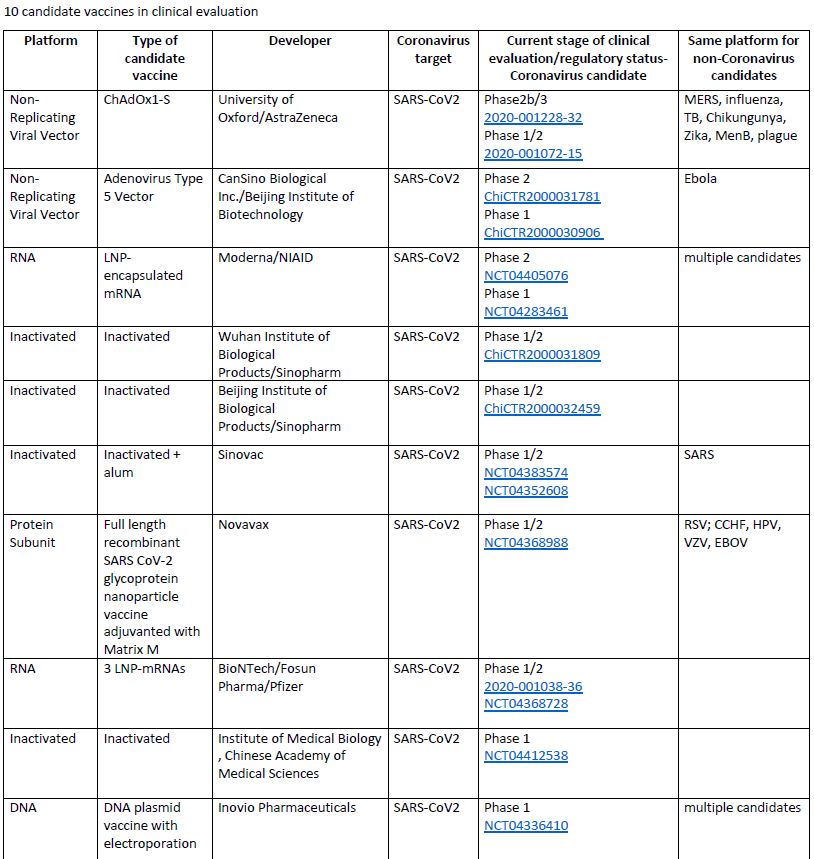
I 10 vaccini ammessi alla fase clinica secondo il documento dell'Oms aggiornato al 9 giugno
In molti hanno giustamente fatto notare che allo stato attuale delle conoscenze non esiste nessuna garanzia che il vaccino in sperimentazione a Oxford si rivelerà efficace per l’eradicazione del CoVid-19.
Ad oggi l’unico studio disponibile, e non ancora sottoposto a peer-review, è quello relativo alla sperimentazione animale di ChAdOx1 nCoV-19 (questo il nome del vaccino) su 6 macachi, che non hanno sviluppato sintomi respiratori e hanno mostrato una buona risposta immunitaria con lo sviluppo di anticorpi IgG, senza effetti collaterali. Nello studio si legge anche che “è stata registrata una significativa riduzione della carica virale nel tratto respiratorio e nel fluido broncoalveolare dei macachi trattati con vaccino rispetto a quelli del gruppo di controllo” (anche se la riduzione non è stata osservata nei campioni di tampone nasale).
Ad aprile si è passati alla sperimentazione umana, con il coinvolgimento di più di 1000 persone volontarie, tra i 18 e i 55 anni, nel Regno Unito: a una metà è stato somministrato il vaccino contro Sars-CoV-2, all’altra metà (il gruppo di controllo) una soluzione placebo. Visti i risultati positivi di immunizzazione e la mancanza di effetti indesiderati gravi, a fine maggio si è deciso di passare alle fasi successive, ampliando la coorte di partecipanti.
Lo studio di fase 2 coinvolge un gruppo di più di 10.000 individui, sempre nel Regno Unito, per stabilire l’efficacia del vaccino su bambini e anziani: verranno infatti incluse le fasce d’età dai 56 ai 69 anni, gli over 70 e bambini dai 5 ai 12 anni. L’università di Oxford ha iniziato anche il programma della fase 3 di sperimentazione, che amplia ulteriormente il numero di individui per rendere statisticamente più solidi i risultati e per far emergere eventuali effetti non riscontrati a numeri ridotti: negli Stati Uniti sono stati coinvolti 30.000 volontari mentre in Brasile, dove il virus circola ancora molto, ne sono stati reclutati 2.000. Gli adulti che si sottoporranno alla fase 2 e 3 verranno divisi in due gruppi: a uno verrà somministrato il vaccino contro Sars-CoV-2, ChAdOx1 nCoV-19, all’altro gruppo, di controllo, verrà somministrato un altro vaccino (MenACWY), inefficace contro il nuovo coronavirus, per misurare la reale efficacia del primo.
Brazilian Health Regulatory Agency approves trial of Oxford #ChAdOx #COVID19 Vaccine @UniofOxford https://t.co/zbzZlatRU9
— Vaccitech (@VaccitechLtd) June 4, 2020
Sebbene dunque l’accordo siglato tra la multinazionale britannica AstraZeneca e il ministero della salute italiano possa essere visto come una scommessa, ad oggi i bookmakers la darebbero come la puntata meno rischiosa.
Del resto prima che Italia, Francia, Germania e Olanda si assicurassero 400 milioni di dosi entro fine anno, AstraZeneca aveva firmato un accordo da 750 milioni di dollari con Gavi (l’alleanza per i vaccini con sede a Ginevra) e Cepi (la Coalition for Epidemic Preparedness Innovations con sede a Oslo) per la produzione e distribuzione di 300 milioni di dosi del vaccino nel mondo entro la fine dell’anno. Inoltre, un accordo è stato anche siglato con il Serum Institute dell’India per la distribuzione di un miliardo di dosi nei Paesi a basso o medio reddito pro-capite, con un impegno a fornirne 400 milioni entro fine anno.
A questi impegni si sommano il supporto finanziario del Regno Unito e quello ancora più ingente proveniente dagli Stati Uniti, che hanno fatto rientrare quello di Oxford tra i 5 vaccini anti-CoVid selezionati per Warp Speed, un programma di finanziamento anti-CoVid sostanzialmente illimitato. Anche Bill Gates a fine aprile aveva dichiarato di voler finanziare il vaccino sviluppato al Jenner Institute, l’istituto di ricerca vaccinale dell’università di Oxford intitolato a Edward Jenner, medico inglese del ‘700 pioniere della vaccinazione contro il vaiolo.
Secondo Pascal Soirot amministratore delegato di AstraZeneca, multinazionale farmaceutica britannica nata nel 1999 dalla fusione di una società inglese (Zeneca) e una svedese (Astra), anche Cina, Brasile, Giappone e Russia hanno espresso interesse per il vaccino sperimentale da loro prodotto. Complessivamente “AstraZeneca si è impegnata per assicurare la produzione di 2 miliardi di dosi su scala globale”, ha dichiarato Lorenzo Wittum di AstraZeneca Italia.
Oxford University’s COVID-19 vaccine: next steps towards broad and equitable global access | University of Oxford https://t.co/hH2aYaDNzd
— Jenner Institute (@JennerInstitute) June 5, 2020
Tra i vaccini sostenuti da Warp Speed c’è quello dell’azienda statunitense Moderna, basato su un’altra biotecnologia rispetto a quello di Oxford. Esistono 4 tipi fondamentali di potenziali vaccini contro Sars-CoV-2 e a ciascuno sono associati costi e benefici. Moderna ha scommesso sulla frontiera delle biotecnologie, un vaccino a Rna, molto promettente, ma che non è mai stato brevettato prima né è mai stato prodotto su larga scala. La tipologia di vaccino sviluppata dal Jenner Institute dell’università di Oxford invece monta il gene della proteina Spike di Sars-CoV-2 su un vettore virale ricombinante, un adenovirus, ovvero una versione depotenziata (incapace di riprodursi) di un virus che causa infezioni alle vie respiratorie negli scimpanzé. È della stessa famiglia di ChAdOx1 il vaccino anti-Ebola, brevettato lo scorso novembre dalla multinazionale statunitense Merck, dopo 5 anni di sperimentazioni.
Un altra tipologia ancora è quella che utilizza una proteina del nuovo coronavirus somministrata con una sostanza adiuvante che facilita l’ingresso del vaccino nell’organismo. A questa tipologia sta lavorando, tra gli altri, la casa farmaceutica GlaxoSmithKline, il cui settore di ricerca e sviluppo è diretto da Rino Rappuoli. Questo vaccino prevede una fase preclinica più lunga, in quanto vanno isolate in laboratorio le proteine, ma secondo Rappuoli garantirebbe una fase di produzione industriale sicura.
Next in @UniofOxford's 'COVID Conversations' series, Professor Sarah Gilbert will talk about the #COVID19 #vaccine trial that she and colleagues in @JennerInstitute and @OxfordVacGroup are working on
— Medical Sciences (@OxfordMedSci) June 15, 2020
? Wednesday 17 June, 1.30pm
? Talk details: https://t.co/DDqzmaWgY9 pic.twitter.com/PPJRSUfKOO
Insomma i cavalli in corsa sono molti e non è detto che sarà uno solo a tagliare il traguardo della commercializzazione. Con il programma Warp Speed gli Stati Uniti hanno puntato contemporaneamente su 5 vaccini, mentre l’Italia finora non sembra aver differenziato gli asset del suo investimento vaccinale.
Come ha fatto notare la giornalista Roberta Villa su scienza in rete, non è facile dire se il governo italiano abbia fatto bene o male a siglare l’accordo con AstraZeneca. Le buone ragioni a supporto della scelta del ministro della salute ci sono, ma ci sono anche le ragioni che avrebbero suggerito maggiore cautela: il vaccino oxoniense ad oggi è quello in fase di sperimentazione più avanzata, ma non è detto che tra qualche settimana non verrà superato da altri prodotti di altre partnership. L’Italia non è la sola ad aver scommesso le sue fiches su AstraZeneca e ha fatto bene a muoversi per tempo: molti Paesi e organizzazioni hanno espresso interesse per il lavoro di Oxford, ma forse si avverte ancora troppo la mancanza di un piano globale e coordinato per la distribuzione del vaccino a tutto il mondo, piano che ad oggi sembra lasciato in mano all’iniziativa dei singoli Paesi e delle singole aziende.
Infine, nel caso sventurato ma non del tutto improbabile in cui lo sviluppo del vaccino di Oxford non dovesse approdare a buon esito, fa notare Roberta Villa, “bisognerebbe conoscere i dettagli dell'accordo per sapere a che punto ciascun Paese potrebbe sganciarsi, e cercare altre alternative”.
Mercoledì 17 giugno Sarah Gilbert, direttrice degli studi sul vaccino del Jenner Institute, nell’ambito delle CoVid Conversation organizzate dall’università di Oxford risponderà ad alcune domande presentando i dati che finora il suo gruppo ha raccolto, e ci fornirà qualche elemento in più per capire se abbiamo imboccato la strada giusta.









