I vaccini a Rna di Pfizer e Moderna e gli altri in fase 3
L’azienda farmaceutica statunitense Pfizer in collaborazione con la tedesca BioNTech il 18 novembre ha annunciato di aver concluso la fase 3 di sperimentazione su circa 43.000 partecipanti e riporta che il vaccino è sicuro e efficace nel 95% dei casi, per tutte le fasce d’età e gruppi etnici testati.
Il primo obiettivo di analisi di efficacia dunque si ritiene raggiunto. Sono stati analizzati 170 pazienti che manifestavano i sintomi di CoVid-19 e 162 sono risultati appartenere al gruppo di controllo cui era stato somministrato il placebo mentre solo 8 erano appartenenti al gruppo sperimentale cui era stato somministrato il vaccino (Bnt162b). Il comunicato sottolinea che nella fascia d’età superiore ai 65 anni l’efficacia si mantiene al 94%. Di 10 forme gravi della malattia osservate però, dichiara l’azienda, una apparteneva al gruppo che ha ricevuto il vaccino. Le reazioni avverse più comuni invece sono state affaticamento e mal di testa dopo la seconda iniezione (a distanza di 28 giorni dalla prima).
Occorrerà vedere e analizzare i risultati pubblicati per avere un quadro completo, affinché la comunità scientifica possa esprimere un giudizio, ma intanto viene rivista al rialzo di 5 punti la percentuale annunciata il 9 novembre e ora la casa newyorkese si appresta a richiedere nel giro di pochi giorni l’autorizzazione all’uso all’autorità statnuitense Food and Drug Administration e a condividere i dati dello studio con le altre autorità garanti negli altri Paesi. 50 milioni di dosi sono attese per la fine dell’anno e 1,3 miliardi per la fine del 2021.
BREAKING: We are proud to announce, along with @BioNTech_Group, that the Phase 3 study of our #COVID19 vaccine candidate has met all primary efficacy endpoints.
— Pfizer Inc. (@pfizer) November 18, 2020
Anche la casa farmaceutica del Massachusetts Moderna il 16 novembre aveva fatto sapere che il vaccino contro il CoVid-19 da lei sperimentato avrebbe un’efficacia del 94,5%.
I due vaccini si basano sull’innovativa tecnologia a Rna messaggero (mRna) e il fatto che entrambi riportino queste elevate percentuali conferma che “la strategia adottata è valida non solo contro il CoVid-19, ma contro tutte le future malattie infettive” ha dichiarato al New York Times Barry Bloom, professore di sanità pubblica a Harvard. La tecnologia a Rna infatti è rapida da ingegnerizzare: consente di seguire, per così dire, eventuali mutazioni del virus, il che è un notevole vantaggio.
Arrotolato in una minuscola capsula lipidica, nel corpo umano viene iniettato un frammento di codice genetico del virus (Sars-CoV-2 è un virus a Rna) che codifica per la proteina Spike, la chiave che apre la serratura rappresentata dai recettori Ace2 presenti nei tessuti delle nostre vie respiratorie e non solo. Sono le nostre stesse cellule a produrre le proteine Spike (ma non tutto il virus). Nei ribosomi (complessi macromolecolari responsabili della sintesi proteica) vengono lette le informazioni dell’mRna virale: iniettandone una quantità controllata vengono prodotte proteine Spike che entrano in circolo, in modo che il nostro organismo si alleni a predisporre una risposta immunitaria tale che una futura infezione non ci coglierà di sorpresa.
Quello che finora sappiamo sulla reale efficacia di questi vaccini però si basa sui soli comunicati stampa delle aziende e non su risultati scientifici analizzati e pubblicati.
Per quanto riguarda quello di Moderna, sappiamo che un team indipendente del National Institute of Health, l’istituto di ricerca pubblico che con Moderna collabora allo studio, ha dato uno sguardo preliminare ai dati di 95 pazienti sintomatici che avevano partecipato allo studio di efficacia in doppio cieco, ovvero a cui era stato somministrato o il vaccino (gruppo sperimentale) o il placebo (gruppo di controllo), senza che né il medico né il paziente ne fossero a conoscenza.
Si è così visto che a 90 di questi era stato somministrato il placebo e che a solo 5 di loro (nessuno dei quali presentava sintomatologia grave, solo lieve) era stato somministrato il vaccino (mRNA-1273 la sua sigla). Di questi 95 pazienti, 15 hanno più di 65 anni e 20 sono afroamericani, ispanici, asiatici o multietnici. L’azienda ha dichiarato che il vaccino si è rivelato sicuro ed efficace in egual modo in tutti questi sotto gruppi. Infatti, dei 30.000 pazienti coinvolti nella fase 3 della sperimentazione, il 37% appartiene a etnie di colore, mentre il 42% è costituito da figure a rischio, in quanto ultra sessantacinquenni o portatori di malattie pregresse come diabete, obesità o disturbi cardiologici.
We just announced that mRNA-1273, our COVID-19 vaccine candidate, has met its primary efficacy endpoint in the first interim analysis of the Phase 3 COVE study.
— Moderna (@moderna_tx) November 16, 2020
Read more: https://t.co/vYWEy8CKCv pic.twitter.com/YuLubU1tlx
Non solo dunque i vaccini non produrrebbero significativi effetti collaterali, ma avrebbero un’efficacia davvero elevata. “Avrei detto sarebbe stato soddisfacente un 75%. Certo, aspiri a un 90-95%, ma mai me lo sarei aspettato” ha commentato sul New York Times il virologo statunitense Anthony Fauci.
Le percentuali, se confermate, sarebbero una notizia davvero straordinaria, poiché superano di molto sia quella a cui è fissata, per questo virus, l’immunità di gregge (occorre che almeno il 60% dell’intera popolazione sia protetta) sia quella del 50% posta come requisito dalla Food and Drug Administration per ottenere l’approvazione.
Tuttavia in assenza di pubblicazioni scientifiche restano diversi punti di domanda, su tutti quello relativo alla durata dell’immunità. Sia Moderna sia Pfizer hanno iniziato la fase 3 il 27 luglio, quindi hanno avuto solo pochi mesi per monitorare lo stato di salute dei pazienti. Entrambi i vaccini a Rna dovrebbero venire somministrati in due dosi, una a distanza di circa un mese dall’altro, ma quanto possa durare la protezione ancora non lo sappiamo. Da studi precedenti sappiamo che gli anticorpi neutralizzanti non durano più di 3-4 mesi. È incoraggiante tuttavia uno studio apparso su biorXiv, dunque non ancora sotto posto a revisione scientifica e non pubblicato, che mostrerebbe una durata maggiore, anche di diversi anni, delle cellule della memoria immunitaria (cellule B e due tipi di cellule T).
Inoltre, sebbene gli studi preclinici sui macachi abbiano mostrato che sia il vaccino di Pfizer sia quello di Moderna sarebbero in grado di bloccare la replicazione del virus anche nelle vie aeree superiori, e quindi aiutare a prevenire la trasmissione del contagio oltre che il manifestarsi della malattia, non sono ancora disponibili dati analoghi sull’uomo.
È poi ancora tutto da affrontare il fronte logistico della distribuzione delle dosi. Oltre alle difficoltà che già si presentano nel raggiungere aree poco fornite del pianeta come zone rurali dell’India e dell’Africa, se ne aggiunge un’altra di natura fisico-biologica. L’Rna è una molecola fragile e il vaccino di Pfizer richiede una catena del freddo piuttosto complessa: deve venir conservato, anche durante il trasporto, a temperature di -70/80°C. Moderna sembra aver risolto in parte queste difficoltà utilizzando una diversa capsula lipidica per proteggere l’Rna. Sono quindi sufficienti temperature di -20°C, ma il vaccino può resistere in frigorifero anche per 30 giorni, ha dichiarato Moderna, e a temperatura ambiente per 12 ore.
Il vaccino di Moderna rientrava nel programma governativo Warp Speed. Moderna ha ricevuto finanziamenti pubblici per 1 miliardo di dollari per sviluppare il vaccino in collaborazione con il National Institute of Health. Ad agosto gli Stati Uniti avevano firmato un accordo per ricevere 100 milioni di dosi per ulteriori 1,5 miliardi di dollari, laddove il vaccino si fosse dimostrato efficace. Accordi analoghi sono stati siglati con Canada, Giappone e Qatar e ora è in corso un dialogo anche con l’Agenzia Europea del farmaco (Ema).
Pfizer non è stata direttamente finanziata da fondi pubblici, ma aveva già firmato accordi con vari Paesi per la garantire distribuzione. Il governo statunitense ha promesso 1,9 miliardi di dollari per 100 milioni di dosi entro dicembre e per garantirsi l’opzione di altri 500 milioni di dosi; 120 milioni per il Giappone, 200 milioni per l’Europa. Entro la fine del 2021 Pfizer e BioNTech hanno promesso di produrre 1,3 miliardi di dosi.
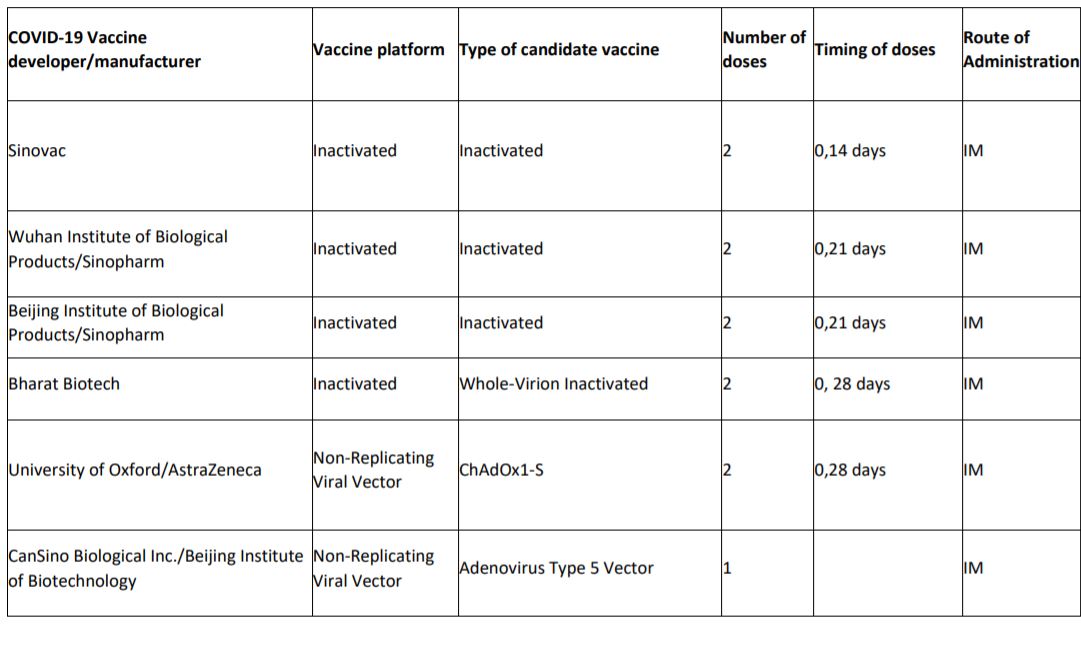
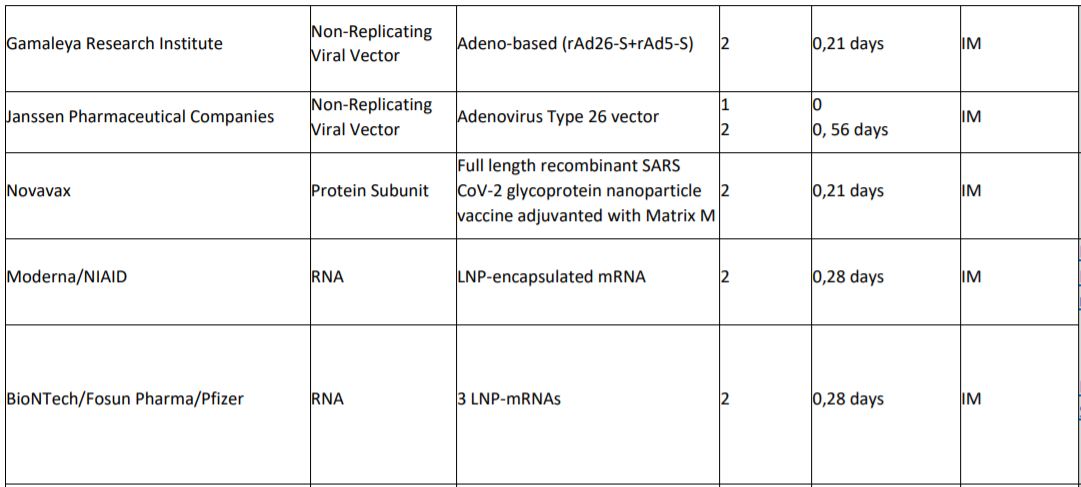
Atlante dei 12 vaccini in fase 3
1 in Europa
L’Europa però aveva firmato lo scorso giugno un accordo per ricevere 400 milioni di dosi del vaccino di Astra Zeneca sviluppato in collaborazione con l’università di Oxford. Secondo quanto riportato da The Guardian sarebbe imminente non solo l’annuncio della sua efficacia, ma addirittura la pubblicazione dei risultati.
Sono 4 le tipologie principali di vaccini che stanno ultimando la fase 3, ciascuna delle quali presenta pro e contro: ia vaccini a Rna ad esempio sono veloci da ingegnerizzare, ma presentano più difficoltà sul fronte logistico. Quello inglese è un vaccino basato sulla tecnologia del vettore virale, un adenovirus che provoca il raffreddore negli scimpanzé. Quello che viene iniettato è un virus che non è in grado di auto-replicarsi, per questo si parla di non-replicating viral vector. Su questa base viene montato un gene di Sars-CoV-2 che codifica per la proteina Spike. La risposta immunitaria attesa è solida, ma talvolta può capitare che il vettore smorzi l’efficacia del vaccino.
1 in Russia
La stessa tipologia a vettore virale (adenovirus) è stata utilizzata dal Gamaleya Research Institute con il supporto dal Fondo russo di investimenti per sviluppare il vaccino rinominato Sputnik V. Da Mosca hanno dichiarato, due giorni dopo l’annuncio di Pfizer, che la sua efficacia raggiungerebbe il 92%. Già ad agosto le autorità russe avevano dato il via libera alla somministrazione del vaccino alla popolazione, prima che iniziasse la fase 3 e dunque prima di veder pubblicati i risultati.
4 in Cina
È basato su un adenovirus anche il vaccino sviluppato dalla Cansino e dal Beijin Institute of Biotechnology, che già a giugno ha ricevuto l’approvazione per venire somministrato ai membri dell’esercito cinese.
La Cina dispone però di altri 3 vaccini che stanno ultimando la fase 3 di sperimentazione, tutti e tre basati su un’altra tecnologia, quella del virus inattivato. È una tecnologia nota e ritenuta affidabile, ma richiede tempo per essere messa a punto. Ci stanno lavorando Sinovac e Sinopharm, quest’ultima in collaborazione sia con il Wuhan Institute of Biological Products sia con il Beijin Institute of Biological Products.
1 in India
Anche la Bharat Biotech indiana sta lavorando alla tipologia a virus inattivato, insieme all’Indian Council of Medical Research e al National Institute of Virology di Pune.
5 in Nord America
Negli Usa oltre ai vaccini a Rna di Pfizer e Moderna, la Johnson & Johnson tramite le Janssen Pharmaceutical Companies sta sviluppando un vaccino a vettore virale (adenovirus), mentre la Novavax ha puntato sulla tecnologia delle proteine ricombinanti più adiuvanti. In questo caso viene iniettata una proteina, la Spike, assieme a delle sostanze adiuvanti che aiutino il sistema immunitario a riconoscere l’intruso. L’inconveniente è che ottenere le proteine purificate in laboratorio richiede tempo.
La stessa strada è stata imboccata dalla canadese Medicago in collaborazione con la Glaxo Smith Kline, che secondo quanto riportato dal New York Times coronavirus vaccine tracker avrebbe iniziato la fase 3 il 12 novembre.