I vaccini contro CoVid-19 entrano nella fase 3

Il documento dell’Organizzazione mondiale della sanità che monitora lo stadio di avanzamento dei vaccini contro il CoVid-19, aggiornato al 22 giugno, dice che ora sono 13 i candidati che sono stati ammessi alla fase clinica di sperimentazione sull’uomo. Come sintetizzato dal Coronavirus vaccine tracker del New York Times, la fase clinica a sua volta si divide in almeno 4 fasi. Nella prima il vaccino viene somministrato a un gruppo ristretto di persone per valutarne la sicurezza, il dosaggio e una prima risposta del sistema immunitario. Se i riscontri sono positivi le stesse valutazioni vengono fatte, nella seconda fase, su una coorte più ampia divisa per fasce d’età: bambini, adulti e anziani. Una volta ottenuti i risultati sperati, si passa a misurare, nella terza fase, l’effettiva efficacia del vaccino su una coorte di decine di migliaia di persone, con test randomizzati e controllati. Randomizzati significa che i volontari vengono distribuiti in modo da annullare gli eventuali fattori di disturbo per lo studio (come condizioni prognostiche che potrebbero confondere i risultati da ascrivere all’azione del vaccino). Mentre controllati significa che viene istituito un gruppo di controllo a cui non viene somministrato il vaccino di cui si vuole testare l’efficacia, ma una soluzione placebo: in tal modo si possono osservare le differenze tra chi ha assunto il vaccino e chi ha assunto il placebo e valutare così la reale efficacia del vaccino.
La quarta fase è quella che prevede l’approvazione del vaccino che si è rivelato più efficace. Ulteriori valutazioni di efficacia vengono fatte anche dopo la fase di commercializzazione che prevede, nel caso di quello contro Sras-CoV-2, la somministrazione a centinaia di milioni di persone già a fine anno e la copertura vaccinale, sul più lungo termine, di pressoché l'intera popolazione umana.
Quello sviluppato dall’università di Oxford e prodotto da AstraZeneca (ChAdOx1 nCoV-19 la sua sigla), con cui l’Italia e altri Paesi europei hanno già firmato un accordo di distribuzione, è stato il primo vaccino sperimentale a entrare nella fase 3. Dopo i test di sicurezza su 1000 persone nel Regno Unito (fase 1) e l’ampliamento a 10.000 persone divise per fasce d’età (fase 2), la valutazione di efficacia è passata alla fase 3 coinvolgendo 30.000 persone negli Stati Uniti e altre 2000 in Brasile per effettuare i test di efficacia randomizzati e controllati.
In the search to find a vaccine to put an end to the coronavirus pandemic, some scientists worry that President Trump's "Operation Warp Speed" is missing out on tried and true vaccine technologies that have over and over again resulted in proven winners. https://t.co/YERNHw8Kx2
— CNN (@CNN) June 17, 2020
Come riporta un articolo su Science, da inizio luglio è attesa la partenza della fase 3 per la valutazione dell’efficacia di altri candidati vaccini. Tra questi, quello sviluppato dall’azienda americana Moderna che rientra nel programma Warp Speed degli Stati Uniti, e quello sviluppato a Pechino dalla SinoVac Biotech. Il primo è basato sull’innovativa biotecnologia a Rna virale, promettente ma che mai è stata brevettata né prodotta su larga scale; il secondo è basato sulla più rodata biotecnologia a virus inattivato che è già stata utilizzata per la Sars.
La necessità di raggiungere risultati solidi in tempi rapidi si scontra però con la difficoltà di inseguire un virus che continua a spostarsi per il mondo. Se Wuhan, New York, Seattle o Milano sarebbero stati luoghi ideali per testare l’efficacia del vaccino fino a qualche mese fa, quando il contagio dilagava in queste città, oggi occorre rincorrere il virus in zone distanti dai laboratori e ospedali in cui si dovrebbe costruire il vaccino.
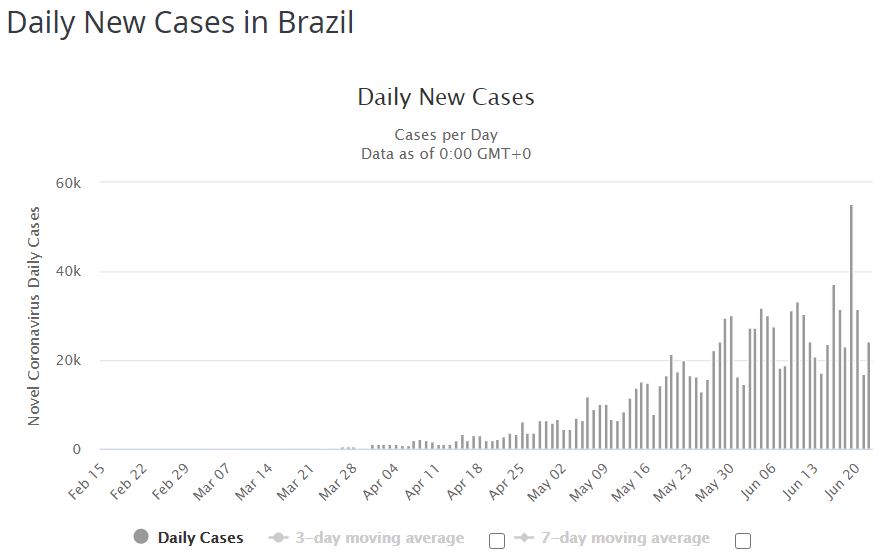
Non solo l'università di Oxford infatti ha firmato un accordo con le autorità sanitarie brasiliane per effettuare le sperimentazioni in Brasile, ma anche la Sinovac di Pechino ha annunciato un accordo con il Butantan Institute di San Paolo per iniziare al più presto i trial in un Paese, il Brasile, in cui le infezioni hanno superato ampiamente il milione di individui e il numero di decessi, 51.000, è secondo solo a quello degli Stati Uniti (122.000).
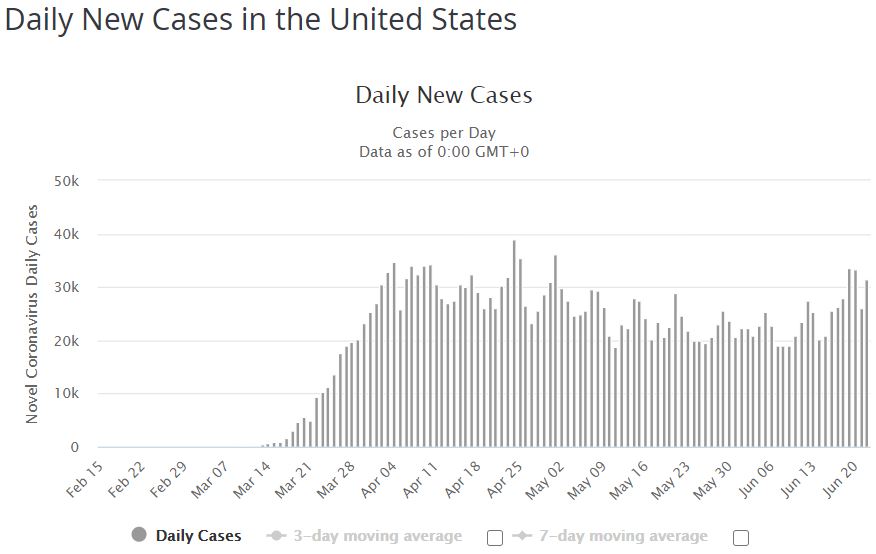
Moderna invece ha annunciato l’11 giugno che il vaccino in fase di valutazione verrà somministrato a 30.000 persone negli Stati Uniti, appoggiandosi all’esperienza e alle strutture già utilizzate per i test sul vaccino contro l’Hiv di ospedali e università americane. Il problema, sottolinea Science, è che ancora non si sa se l’attuale tasso di circolazione del virus negli Stati Uniti (più basso rispetto ad aprile e maggio, ma ancora consistente) sia e sarà sufficiente per ottenere risultati solidi nei tempi strettissimi che sono stati imposti, più che auspicati, dal programma Warp Speed, che oltre a quella di Moderna è pronto a sostenere la fase 3 di altri 2 vaccini dei 5 totali che sta supportando.
Anche l’Oms è pronta a sostenere la fase 3 dei vaccini che rientrano nel programma Solidarity, anche se ancora non ha annunciato quali sono i candidati. La strategia però è quella di ricalcare le orme di quanto è stato fatto per Ebola in Guinea nel 2015 e in Repubblica Democratica del Congo nel 2018. In quest’ultimo Paese 20 squadre di 15 membri ciascuna, nonostante la guerra, sono riuscite a somministrare il vaccino a 300.000 persone, riporta Science.
Il corpo umano è una macchina dalla complessità inimmaginabile e le nostre conoscenze del suo funzionamento sono ben lontane dall’onniscienza: lo dimostra la risposta del nostro sistema immunitario al Sars-CoV-2, che ha riservato parecchie sorprese e ancora oggi è solo in parte compresa. Per essere certi che un vaccino funzioni senza controindicazioni non basteranno le decine di migliaia di persone coinvolte nella fase 3 dei diversi vaccini sperimentali. Ogni coorte ha le sue particolarità, dovute o al corredo genetico o alle condizioni ambientali-culturali che hanno favorito lo sviluppo di alcuni tratti anziché di altri. Qualche migliaio di individui non necessariamente è rappresentativo della totalità delle caratteristiche di più di 7 miliardi di persone, cui è destinata la versione finale del vaccino. Quella che potrebbe sembrare la fase finale di sviluppo del vaccino, ovvero la sua approvazione da parte delle autorità competenti (Fda per gli Usa, Aifa per l’Italia), in realtà è un altro passaggio che permette di passare alla distribuzione su più larga scala, per ampliare ulteriormente la coorte di partecipanti su cui occorrerà raccogliere i dati e da cui non è improbabile aspettarsi sorprese. La strada è ancora lunga.