Vaccino, AstraZeneca sospende fase 3: non è detto sia una cattiva notizia
La fase 3 della sperimentazione del vaccino sviluppato all’università di Oxford in collaborazione con l’azienda AstraZeneca è stata temporaneamente sospesa per analizzare i dati relativi alla sicurezza. Una nota dell’azienda ripresa da StatNews riporta che si tratta di una procedura di routine nel momento in cui si riscontrano effetti collaterali inattesi durante la sperimentazione. La reazione avversa riguarderebbe un partecipante alla somministrazione del prototipo di vaccino (AZD1222) avvenuta nel Regno Unito.
Here's the full statement $azn sent us for this story: https://t.co/kmjVIHGY1T pic.twitter.com/DNadhv0KbD
— Rebecca Robbins (@RebeccaDRobbins) September 8, 2020
Il vaccino di Oxford/AstraZeneca era stato il primo a entrare, già a giugno, nella fase 3, che prevede la somministrazione del vaccino a circa 50.000 partecipanti tra Regno Unito, India, Sud Africa, Brasile e Stati Uniti (solo qui 30.000, distribuiti in più di 60 località). A luglio erano stati pubblicati su The Lancet i risultati delle prime due fasi della sperimentazione effettuata su 1000 persone nel Regno Unito. I risultati erano incoraggianti: si era riscontrata una buona risposta immunitaria nei pazienti sia in termini di anticorpi sia di linfociti T. Nel 60% degli individui erano emersi lievi effetti collaterali (tra cui febbre, mal di testa, dolori muscolari e rossore nel sito di inoculazione), tutti risolti nell’intervallo di tempo considerato dallo studio.
Secondo quanto riportato dal New York Times il partecipante che ha fatto propendere l'azienda anglo-svedese per la sospensione dell'arruolamento di nuovi partecipanti ai trial sarebbe affetto da mielite trasversa, una sindrome infiammatoria che colpisce la spina dorsale e che viene spesso innescata da infezioni virali. Non è però chiaro a quando risalga questa diagnosi e se sia in qualche modo legata alla somministrazione del vaccino sperimentale.
Nella nota relativa alla sospensione della fase 3 AstraZeneca specifica che l’insorgere di malattie può essere un’eventualità indipendente dalla somministrazione, ma tale eventualità deve essere valutata attentamente. E aggiunge: “Siamo impegnati nel garantire la sicurezza dei nostri partecipanti e nel garantire i più alti standard nei nostri trial clinici”.
Secondo il ministro della salute Roberto Speranza, l’accordo di distribuzione del vaccino firmato da Italia, Francia, Germania e Olanda con AstraZeneca lo scorso giugno sarebbe servito da acceleratore per la firma del contratto, avvenuta pochi giorni fa, tra la Commissione Europea e l’azienda farmaceutica anglo-svedese. Speranza aveva dichiarato che le prime dosi del vaccino saranno disponibili entro fine 2020. Al momento non è chiaro come la battuta di arresto annunciata da AstraZeneca si ripercuoterà sui tempi di sviluppo e produzione del vaccino.
"Siamo in attesa che il caso sottoposto al comitato indipendente di esperti venga analizzato" ha dichiarato in una nota Piero di Lorenzo, amministratore delegato dell'istituto di ricerca Irbm di Pomezia che sta collaborando alla messa a punto del vaccino Atrazeneca-Oxford. "I test sui vaccini, anche quelli anti Covid, nonostante l'emergenza pandemica, sono severi, rigorosi e affidabili. Prova di questo è stata la sospensione volontaria della sperimentazione da parte di AstraZeneca” ha aggiunto Di Lorenzo.
L’11 agosto la Russia è stato il primo Paese al mondo ad annunciare l’approvazione di un vaccino contro Sars-CoV-2, chiamandolo Sputnik V, un evidente richiamo alla frenetica corsa allo spazio di era sovietica. Il 4 settembre sono stati pubblicati su The Lancet i dati relativi alla sperimentazione di fase 1 e 2, tutti positivi in termini di risposta immunitaria, ma basati su soli 76 partecipanti. Un gruppo di scienziati tra cui figura anche il biologo della Temple University di Philadelphia Enrico Bucci, ha firmato una lettera indirizzata al direttore della rivista The Lancet, Richard Horton, per chiedere chiarimenti su alcune incongruenze presenti nello studio. Inoltre, sebbene sia in programma l’inizio della fase 3 che dovrebbe coinvolgere 40.000 partecipanti, non esistono al momento dati relativi alla fase 3. Ciononostante già da settembre in Russia è prevista la produzione di 500 milioni di dosi annue del vaccino.
La fretta non è buona consigliera e il detto vale anche al di fuori delle sperimentazioni vaccinali. La Food and Drug Administration (Fda) statunitense ha validato il 23 agosto l’utilizzo del plasma iperimmune estratto da pazienti convalescenti come trattamento contro il CoVid-19. I dati disponibili però non sembrano supportare la solidità di una simile decisione. Indiscrezioni vorrebbero che il presidente degli Stati Uniti Donald Trump abbia sollecitato la rapida approvazione di una terapia che gode di una buona reputazione tra la gente comune, un po’ come era accaduto per l’idrossiclorochina. Un recente lavoro pubblicato in preprint su MedrXiv riporta i dati di uno studio controllato e randomizzato sull’impiego della terapia del plasma iperimmune, concludendo in sfavore di una sua efficacia.
Secondo il documento dell’Organizzazione mondiale della sanità aggiornato all’8 settembre, sono 9 i vaccini in via di sviluppo che hanno avviato la fase 3. La stessa Oms pochi giorni fa aveva annunciato che secondo le stime attuali non ci si dovrebbe aspettare l’avvio delle vaccinazioni di massa contro CoVid-19 prima della metà del 2021.
Il vaccino che ha contribuito a spegnere un epidemia di Ebola in Congo questa primavera è stato sviluppato in 5 anni, un tempo considerato record fino ad oggi. Gli sforzi profusi da governi e compagnie farmaceutiche nello sviluppo di un vaccino contro CoVid-19 sono senza precedenti, ma occorre ricordare che Sars-CoV-2 è un virus nuovo, della cui esistenza ci siamo accorti meno di un anno fa e i cui effetti sono ancora oggi solo parzialmente conosciuti. Ciononostante molti esponenti politici non hanno esitato a dichiarare a più riprese che il vaccino sarà pronto entro fine 2020.
La battuta di arresto annunciata da AstraZeneca è pertanto stata generalmente accolta come una cattiva notizia. Se però l’anno prossimo dovesse essere disponibile un vaccino sicuro ed efficace, distribuito magari qualche mese dopo rispetto a quanto annunciato dai più ottimisti, sarà anche grazie all’interruzione temporanea della fase 3, che sarà servita a rivalutare tutti gli standard di sicurezza. Una simile scelta andrebbe in tal caso reinterpretata come una buona notizia.
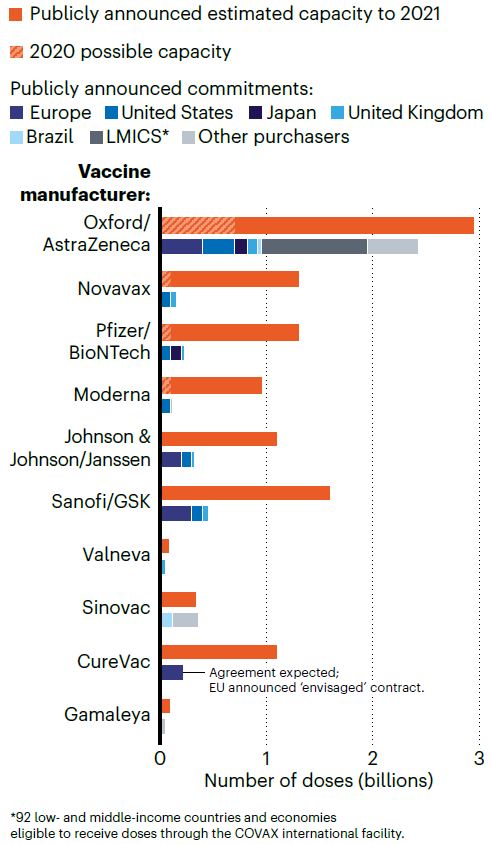
Capacità di produzione di vaccini dichiarata dalle case farmaceutiche (arancione) e pre-ordini già effettuati dai singoli Stati (blu). Nature 24 agosto, Ewen Callaway.
Nel frattempo però potrebbe essere opportuno fare un appello di trasparenza a riguardo degli accordi che i governi hanno siglato con le case farmaceutiche per la distribuzione delle dosi vaccinali. Che cosa questi accordi prevedano in caso il vaccino non venga sviluppato, non sia efficace a sufficienza o non sia pronto nei tempi previsti ad oggi non è noto. Né sono noti i dettagli finanziari. Diversi prodotti avranno costi differenti: secondo quanto riportato da Ewen Callaway su Nature, gli Stati Uniti ad esempio pagherebbero 4 dollari una dose del vaccino AstraZeneca (basato sulla biotecnologia dell'adenovirus) e 25 dollari una dose del vaccino di Moderna (basato sull'Rna virale). Alcuni vaccini tuttavia, soprattutto quelli a Rna, sono basati su biotecnologie per cui non è mai stata nemmeno provata una produzione su larga scala. È pertanto verosimile aspettarsi che più di un solo prodotto taglierà il traguardo della validazione, ma un altro punto su cui occorre chiedere chiarezza e trasparenza è un piano di distribuzione dei vaccini che sia equo e non condizionato dalle disponibilità finanziarie dei singoli Paesi.